به نام خدا
موضوع : اهن زنگ نزن
تهیه و تنظیم : مهدی حکیمی
آهن زنگ نزن
اصطلاح
آهن زنگ نزن به چه معناست؟ به علت فعال بودن فلز آهن وقتی در مجاورت
اکسیژن و رطوبت قرار می گیرد ، اصطلاحا ((زنگ می زند)). در واقع آهن با
اکسیژن تشکیل اکسید آهن داده که قرمز رنگ بوده و روی آن را می پوشاند. برای
استفاده بهتر از آهن و جلوگیری از زنگ زدن آن، آن را گالوانیزه می کنند .
در این روش آهن را با فلز روی پوشش می دهند و در نتیجه زمانی که آهن
گالوانیزه در معرض محیط مرطوب قرار می گیرد زنگ نمی زند.
اصطلاح
آهن زنگ نزن در مورد این فلز اشتباه رایجی است. زمانی که کربن به آهن
اضافه شود ، تبدیل به آلیاژ می شود و از حالت عنصری خارج می شود. به این
آلیاژ، فولاد گفته می شود که خواصی بهتر از آهن دارد. یک نوع از این
فولادها، فولاد زنگ نزن هستند که علاوه بر آهن و کربن عناصری دیگری مانند
کروم به آن اضافه شده که باعث ایجاد مقاومت در برابر زنگ زدن در آنها می
شود.
پس اصطلاح آهن زنگ نزن اشتباه بوده و فولاد زنگ نزن صحیح می باشد.
موارد کاربرد:
مخازن نگهدارنده موادشیمیایی – لوازم آشپزخانه – لوله های صنعتی –نمای خارجی بناها – استراکچرها
صنایع پتروشیمی – کاغذسازی –
قند و نیشکر همچنین کشتی سازی این دسته ازفولادهای ضدزنگ هردو
ساختارمتالورژیکی مربوط به فاز های فریت و آستنیت را همزمان درخودداشته
ازاینرو آنها را فولادهای ضدزنگ duplex نیز
نامگذاری کرده اند این فولادها حاوی مقادیری ازعنصرنیکل به منظور
پایدارکننده فازآستنیت و حصول خواص انعطاف پذیری همچنین مقادیری از عنصر
کرم به منظورپایدارکننده فازفریت و حصول خواص استحکام و چقرمگی مناسب
درفولادمی باشند.
آهن زنگ نزن
فرایند زنگ زدن
زنگ
زدن عبارتی است که به اکسیداسیون آهن اطلاق میشود. اکسیداسیون آهن معمولا
از طریق واکنش با اکسیژن صورت میگیرد اما نوعهای دیگری از زنگ زدن وجود
دارد که حاصل واکنش آهن و کلر است که به آن زنگ سبز میگویند. “زنگ” نام
متداول یکی از ترکیبات بسیار رایج یعنی اکسید آهن با فرمول Fe2O3 است. این
نام رایج است زیرا آهن به سرعت با اکسیژن ترکیب شده و تشکیل زنگ آهن را می
دهد. در حقیقت آهن را به ندرت می توان به صورت خالص در طبیعت پیدا کرد. زنگ
آهن (یا فولاد) نمونه ای از فرایند خوردگی است: فرایند الکتروشیمیایی شامل
آند (یک قطعه فلز که به راحتی الکترون از دست می دهد)، الکترولیت (مایعی
که به حرکت الکترون ها کمک می کند) و یک کاتد (یک قطعه فلز که به راحتی
الکترون می پذیرد) است. وقتی فلزی خورده می شود، الکترولیت به تولید اکسیژن
در آند کمک می کند. سپس اکسیژن با فلز ترکیب شده و الکترون آزاد می شود.
وقتی الکترون ها از طریق الکترولیت به سمت کاتد جریان می یابند، آند با
جریان الکتریکی حذف می شود یا به کاتیون های فلزی تبدیل شده و زنگ تشکیل می
شود.
اکسیده شدن آهن
برای
این که آهن اکسید شود به سه ماده نیاز است: آهن، آب و اکسیژن. و اما
فرایند زنگ زدن: با افتادن یک قطره آب بر روی اشیای آهن فورا دو اتفاق می
افتد. نخست آن که آب به عنوان یک الکترولیت خوب با دی اکسیدکربن موجود در
هوا واکنش داده و اسید کربنیک که یک اسید ضعیف است تشکیل می شود. اسید
کربنیک نسبت به آب، الکترولیت بهتری است. پس از تشکیل اسید و حل شدن آهن در
آن، ملکول های آب به اجزای سازنده آن یعنی اکسیژن و هیدروژن تبدیل می شود.
اکسیژن آزاد و آهن حل شده با هم پیوند داده و اکسید آهن را تشکیل می دهند.
در این فرایند الکترون آزاد می شود. الکترون های آزاد از بخش آند که همان
آهن است به سمت کاتد که ممکن است فلزی با واکنش پذیری کمتر از آهن یا بخش
دیگری از سطح آهنی باشد، جریان می یابد. مایعاتی مانند باران های اسیدی، آب
دریا و افشانه نمکی برای ذوب کردن برف جاده های یخی به علت ترکیبات موجود
در آنها نسبت به آب الکترولیت های قوی تری هستند. به همین دلیل آهن و فلزات
دیگر در این محیط ها با سرعت بیشتری زنگ زده و خورده می شوند.
چرا آهن زنگ می زند؟
آیا
توجّه کرده اید که بعضی از فلزات زنگ می زنند و بعضی دیگر٬زنگ نمی
زنند؟آهن معموأ زنگ می زند. به همین علّت است که وقتی رنگ قسمتی از بدنه
اتومبیل از بین می رود٬هوا باعث می شود که آهن زیر قسمت رنگ شده خیلی زود
زنگ بزند.
برای
آن که آهن با اکسیژن موجود در هوا ترکیب می شود و اکسیدآهن قرمز رنگ را
(که همان زنگ آهن است) تولید می کند. در هر صورت نوعی آهن وجود دارد که زنگ
نمی زند. اختراع یاکشف این آهن امری تصادفی بود! در سال۱۹۱۳ هری بریرلی٬
که متخصص ذوب فلزات بود٬ برای ساختن لوله تفنگ٬ دنبال فلزی مناسب می گشت.
از این رو فلزات گوناگون را با هم ترکیب کردو آلیاژهای مختلفی به دست آورد.
امّا پس از انجام آزمایش ها٬ تمام نمونه ها را به گوشه ای انداخت. چند ماه
بعد متوجّه شد در حالی که همه نمونه های دور ریخته شده٬ زنگ زده اند٬ یکی
از آنها زنگ نزده است! بریرلی این آلیاژ را با دقّت بررسی کرد و فهمید که
۱۴٪ آن کروم است.
به
این ترتیب فلز زنگ نزن یا استنلس استیل وارد زندگی بشر شد. امروزه اغلب
لوازم آشپزخانه ها از آهن زنگ نزن هستند. جنس بیشتر دیگ ها٬ کتری ها٬ ماهی
تابه ها٬ قاشق و چنگال ها٬ چاقو ها و لگن ظرفشویی آشپزخانه ها از آهن زنگ
نزن است؛ همین طور بسیاری از لوازم جرّاحی و قطعات خودرو ها از این فلز
ساخته می شوند. فولاد زنگ نزن ، جزو فلزات بسیار مقاوم در برابر خوردگی است
و در صنایع شیر آلات مورد استفاده قرار میگیرد. این نوع فولاد ، آلیاژ
فولاد با کروم میباشد و گاهی نیکل نیز به این آلیاژ اضافه میشود.
نکته:کروم یا کرومیوم فلزی سخت٬خاکستری و دیر گداز است با علامت اختصاریcr.
نکته:آلیاژ فلزی است که از ترکیب دو یا چند فلز به دست می آید.
کاربردهای آهن
کاربرد
آهن از تمامی فلزات بیشتر است و 95 درصد فلزات تولید شده در سراسر جهان را
تشکیل میدهد. قیمت ارزان و مقاومت بالای ترکیب آن استفاده از آنرا بخصوص
در اتومبیلها ، بدنه کشتیهای بزرگ و ساختمانها اجتناب ناپذیر میکند.
فولاد معروفترین آلیاژ آهن است و تعدادی از گونههای آهن به شرح زیر
میباشد:
•
آهن خام که دارای 5%- 4% کربن و مقادیر متفاوتی ناخالصی از قبیل گوگرد ،
سیلیکون و فسفر است و اهمیت آن فقط به این علت است که در مرحله میانی مسیر
سنگ آهن تا چدن و فولاد قرار دارد.
•
چدن ، شامل 5/3%-2% کربن و مقدار کمی منگنز میباشد. ناخالصیهای موجود در
آهن خام مثل گوگرد و فسفر که خصوصیات آنرا تحت تاثیر منفی قرار میدهد، در
چدن تا حد قابل قبولی کاهش مییابند. نقطه ذوب چدن بین k 1470-1420
میباشد که از هر دو ترکیب اصلی آن کمتر است و آنرا به اولین محصول ذوب شده
پس از گرم شدن همزمان کربن و آهن تبدیل میکند. چدن بسیار محکم ، سخت و
شکننده میباشد. چدن مورد استفاده حتی چدن گرمای سفید موجب شکستن اجسام
میشود.
• فولاد کربن شامل 5/1% – 5/0% کربن و مقادیر کم منگنز ، گوگرد ، فسفر و سیلیکون است.
•
آهن ورزیده ( آهن نرم) دارای کمتر از 5/0% کربن میباشد و محصولی محکم و
چکشخوار است، اما به اندازه آهن خام گدازپذیر نیست. حاوی مقادیر بسیار کمی
کربن است ( چند دهم درصد). اگر یک لبه آن تیز شود، بهسرعت تیزی خود را از
دست میدهد.
فولادهای
آلیاژ حاوی مقادیر متفاوتی کربن بعلاوه فلزات دیگر مانند کروم ، وانادیم ،
مولیبدن ، نیکل ، تنگستن و … میباشد. اکسیدهای آهن برای ساخت ذخیره
مغناطیسی در کامپیوتر مورد استفاده قرار میگیرند. آنها اغلب با ترکیبات
دیگری مخلوط شده و خصوصیات مغناطیسی خود را بصورت محلول هم حفظ میکنند.
انواع پوشش های محافظ آهن
پوشش های رنگها و جلاها
سادهترین
راه مبارزه با خوردگی ، اعمال یک لایه رنگ است. با استفاده از رنگها
بصورت آستر و رویه ، میتوان ارتباط فلزات را با محیط تا اندازهای قطع
کرد و در نتیجه موجب محافظت تاسیسات فلزی شد. به روشهای سادهای میتوان
رنگها را بروی فلزات ثابت کرد که میتوان روش پاششی را نام برد. به کمک
روشهای رنگدهی ، میتوان ضخامت معینی از رنگها را روی تاسیسات فلزی قرار
داد. آخرین پدیده در صنایع رنگ سازی ساخت رنگهای الکتروستاتیک است که به
میدان الکتریکی پاسخ میدهند و به این ترتیب میتوان از پراکندگی و تلف
شدن رنگ جلوگیری کرد.
پوشش های فسفاتی و کروماتی
این
پوششها که پوششهای تبدیلی نامیده میشوند، پوششهایی هستند که از خود فلز
ایجاد میشوند. فسفاتها و کروماتها نامحلولاند. با استفاده از محلولهای
معینی مثل اسید سولفوریک با مقدار معینی از نمکهای فسفات ، قسمت سطحی
قطعات فلزی را تبدیل به فسفات یا کرومات آن فلز میکنند و در نتیجه ، به
سطح قطعه فلز چسبیده و بعنوان پوششهای محافظ در محیطهای خنثی میتوانند
کارایی داشته باشند. این پوششها بیشتر به این دلیل فراهم میشوند که از
روی آنها بتوان پوششهای رنگ را بر روی قطعات فلزی بکار برد. پس پوششهای
فسفاتی ، کروماتی ، بعنوان آستر نیز در قطعات صنعتی میتوانند عمل کنند؛
چرا که وجود این پوشش ، ارتباط رنگ با قطعه را محکمتر میسازد. رنگ کم و
بیش دارای تحلخل است و اگر خوب فراهم نشود، نمیتواند از خوردگی جلوگیری
کند.
پوشش های اکسید فلزات
اکسید
برخی فلزات بر روی خود فلزات ، از خوردگی جلوگیری میکند. بعنوان مثال ،
میتوان تحت عوامل کنترل شده ، لایهای از اکسید آلومینیوم بر روی
آلومینیوم نشاند. اکسید آلومینیوم رنگ خوبی دارد و اکسید آن به سطح فلز
میچسبد و باعث میشود که اتمسفر به آن اثر نکرده و مقاومت خوبی در
مقابل خوردگی داشته باشد. همچنین اکسید آلومینیوم رنگپذیر است و میتوان
با الکترولیز و غوطهوری ، آن را رنگ کرد. اکسید آلومینیوم دارای تخلخل و
حفرههای شش وجهی است که با الکترولیز ، رنگ در این حفرهها قرار میگیرد.
همچنین با پدیده الکترولیز ، آهن را به اکسید آهن سیاه رنگ (البته بصورت
کنترل شده) تبدیل میکنند که مقاوم در برابر خوردگی است که به آن
“سیاهکاری آهن یا فولاد” میگویند که در قطعات یدکی ماشین دیده میشود.
پوشش های گالوانیزه
گالوانیزه
کردن (Galvanizing) ، پوشش دادن آهن و فولاد با روی است. گالوانیزه ، بطرق
مختلف انجام میگیرد که یکی از این طرق ، آبکاری با برق است. در آبکاری
با برق ، قطعهای که میخواهیم گالوانیزه کنیم، کاتد الکترولیز را تشکیل
میدهد و فلز روی در آند قرار میگیرد. یکی دیگر از روشهای گالوانیزه ،
استفاده از فلز مذاب یا روی مذاب است. روی دارای نقطه ذوب پایینی است. در
گالوانیزه با روی مذاب آن را بصورت مذاب در حمام مورد استفاده قرار
میدهند و با استفاده از غوطهور سازی فلز در روی مذاب ، لایهای از روی
در سطح فلز تشکیل میشود که به این پدیده ، غوطهوری داغ (Hot dip
galvanizing) میگویند. لولههای گالوانیزه در ساخت قطعات مختلف ، در لوله
کشی منازل و آبرسانی و … مورد استفاده قرار میگیرند.
پوشش های قلع
قلع
از فلزاتی است که ذاتا براحتی اکسید میشود و از طریق ایجاد اکسید در
مقابل اتمسفر مقاوم میشود و در محیطهای بسیار خورنده مثل اسیدها و نمکها و
… بخوبی پایداری میکند. به همین دلیل در موارد حساس که خوردگی قابل
کنترل نیست، از قطعات قلع یا پوششهای قلع استفاده میشود. مصرف زیاد این
نوع پوششها ، در صنعت کنسروسازی میباشد که بر روی ظروف آهنی این پوششها
را قرار میدهند.
پوشش های کادمیم
این
پوششها بر روی فولاد از طریق آبگیری انجام میگیرد. معمولا پیچ و
مهرههای فولادی با این فلز ، روکش داده میشوند. روکش کادمیم مخافظ خوبی
برای کالاهای آهنی و فولادی در برابر زنگ زدگی و فسادتدریجی در اثر هوا می
باشد. روکش کادمیم بیشتر قسمت های اساسی هواپیماها و کشتی ها و کالاهایی که
در آب و هوای گرمسیری مصرف دارد، به کار برده می شود. پوشش های کادمیم
مخصوصا در محیط های طبیعی موثرند. مقاومت این پوشش ها در مقابل فساد تدریجی
در مناطق روستایی بیشتر از مناطق صنعتی است.
===================
روش های کنترل زنگ زدن فلزات
ماده
ای که به طور ذاتی نسبت به محیط اطراف خود مقاومت نشان می دهد و پوسیده
نمی شود (البته به طور ایده آل)، اولین انتخاب در نیازهای مکانیکی و
اقتصادی خواهد بود؛ متاسفانه اغلب چنین نیست و بسیاری از مواد به روشی برای
کنترل زنگ خوردگی خود نیاز دارند؛ به همین دلیل سه روش عمده برای این کار
وجود دارد:
اصلاح محیط اطراف ماده ای که در معرض این محیط قرار دارد
روش های کنترل الکتریکی
استفاده از روکش های محافظ
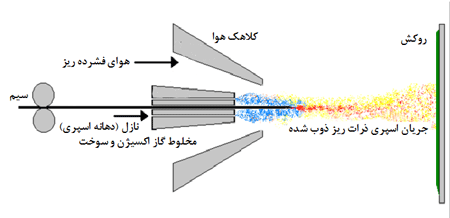
لایه نشانی و روکش به روش اسپری حرارتی برای کنترل زنگ زدن:
روکش
محافظی که به روش حرارتی روی ماده مورد نظر اسپری می شود، برای بسیاری از
مواد مورد استفاده است. در این روش، گزینه های لازم برای روکش کردن مواد و
اسپری بسیار زیاد است. این روش به سه گروه اصلی تقسیم می شود:
روکش آندی
روکش کاتدی
روکش خنثی یا بی طرف
|
روش اسپری برای روکش کردن فلزات
|
 |
Click this bar to view the full image. |
روکش آندی
روکش آندی برای محافظت زیرلایه های آهن و فولاد تقریبا فقط به روکش های روی (Zn) و آلومینیوم (Al) یا
آلیاژهای آن ها محدود می شود. محافظ زنگ زدن این زیرلایه بایستی محافظ
کاتدی یا محافظ قربانی باشد. زیرلایه نقش کاتد را در این روش ایفا کرده و
روکش روی آن، نقش آند قربانی را خواهد داشت. مکانیسم محافظت زنگ خوردگی
فلزات به دو دسته تقسیم می شود:
محافظت کاتدی یا قربانی شدن روکش
سد محافظ در برابر محیط اطراف
حال به توضیح این روش ها می پردازیم.
روکش قربانی:
یک روش پیچیده تر برای روکش کردن، اعمال اندکی بار منفی به فلز است؛ پس واکنش این فلز به صورت M → M2+ + 2e-سخت
تر اتفاق خواهد افتاد. برای این کار می توان با فراهم کردن بار منفی و
اعمال آن به روکشی از یک فلز فعال تر ، به این هدف دست یافت. یعنی یک روش
رایج برای محافظت فولاد، لایه نشانی آن با لایه نازکی از روی است ؛
این فرایند ” گالوانیزه کردن” نامیده
می شود. روکش روی، واکنش پذیری بیش تر از آهن دارد و تمایل دارد به طور
انتخابی زنگ بخورد. حل شدن این روکش قربانی ، الکترون هایی را به جا می
گذارد که در آهن جمع می شوند و آن را کاتدی می کنند؛ بنابراین از خوردگی و
حل شدن آهن جلوگیری می شود(شکل پایین، سمت چپ).
 |
Click this bar to view the full image. |
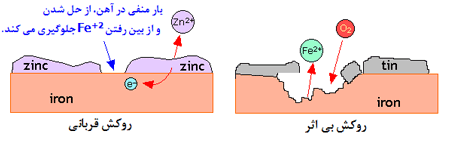
تأثیر
روکش کردن آهن با یک فلز که واکنش پذیری کم تری دارد، یک پدیده جالب به
وجود می آورد. یک مثال خوب از این حالت، روکشی از قلع است(شکل بالا، سمت
راست). تا جایی که روکش قلع دست نخورده باقی می ماند، همه چیز خوب است؛ اما
حتی اگر قسمت کوچکی از آهنی که در زیر قلع قرار گرفته، در معرض رطوبت محیط
اطراف قرار بگیرد، پوسیدگی آغاز می شود. الکترون ها از آهن آزاد شده و به
سمت قلع می آیند و آهن را آندی تر می کنند؛ پس اکنون قلع، پوسیدگی آهن را
بیش تر می کند! حتما زنگ خوردن قوطی کنسروها را بعد از باز شدن درب آن ها
دیده اید.
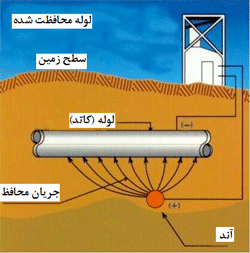
محافظت کاتدی:
یک
روش عالی برای این که بارهای الکتریکی منفی به طور پیوسته در روی فلز
باقی بمانند، آن است که از حل شدن و از بین رفتن یون های مثبت جلوگیری شود.
از آن جایی که کل سطح به وضعیت کاتدی در می آید، این روش را” محافظت کاتدی” می
گویند. منبع الکترون ها می تواند یک منبع تغذیه جریان مستقیم خارجی باشد
(این روش برای محافظت خط لوله های نفت و دیگر تجهیزات زیر خاک به کار می
رود) یا می تواند زنگ خوردگی فلز فعال دیگری مانند تکه ای آلومینیوم یا روی
در زیر زمین و در کنار فلز اصلی باشد؛ در مخزن پروپان شکل زیر در زیر زمین
چنین کاری صورت گرفته است:
روکش خنثی:
مواد
خنثایی مانند آلومینیوم یا سرامیک های اکسید کروم با حذف محیط بسیار
خورنده از ماده ای که استعداد زنگ زدن را دارد، محافظ های خوبی برای زنگ
زدگی هستند. معمولا یک ماده خنثی، حتی اگر روکش آن تا اندازه ای نشت پذیر
باشد (یک استثنا برای این حالت، فولاد زنگ نزن است که حذف اکسیژن می تواند
باعث زنگ زدن شکاف دار آن ها شود و روکش های پیوندی نیکل کروم برای جلوگیری
از زنگ زدن چنین موادی مناسب هستند) سرعت زنگ زدن را زیاد نمی کنند. اما
در هر حالت برای محافظت بیش تر، ضخیم ترین و متراکم ترین روکش های اسپری
پلاسما لازم اند.